Grundlagen der pH-Wertmessung mit Wasserstoffelektroden
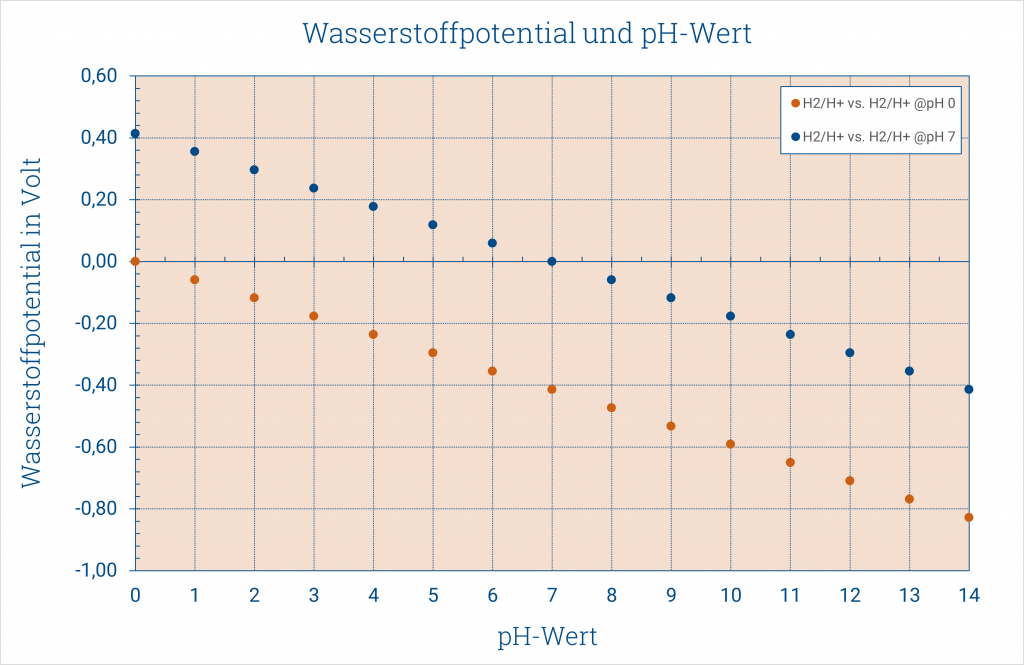
Wasserstoffpotential und pH-Wert
Das Wasserstoffpotential hängt direkt von der Aktivität bzw. Konzentrationen der Hydroniumionen und damit vom pH-Wert der Lösung ab. Der pH-Wert selbst ist definiert als der negative dekadische Logarithmus der Wasserstoffionenaktivität. Die Aktivität ist das Produkt aus Konzentration und Aktivitätskoeffizient. Letzterer kann in verdünnten Lösungen nur näherungsweise bestimmt werden. Damit kann auch die Messung des pH-Werts entsprechend seiner Definition nur in guter Annäherung erfolgen.
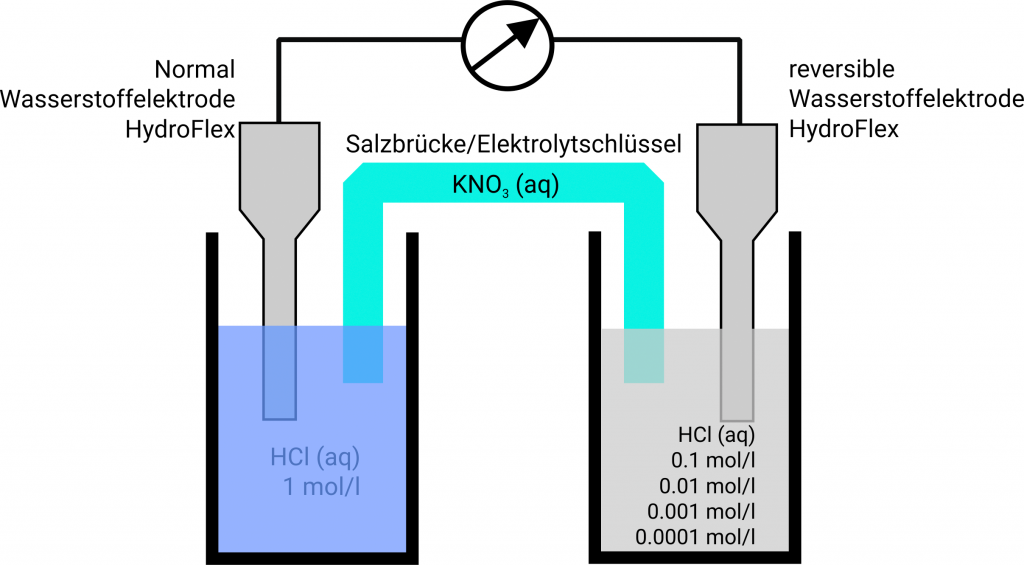
Konzentrationskette aus zwei Platinwasserstoffhalbzellen in Salzsäure
Bringt man zwei Platinwasserstoffelektroden, von denen eine in eine Säure der Protonenkonzentration 1 mol/l, also pH = 0, (Normalwasserstoffelektrode, NHE) und die zweite in einer Lösung unbekannter Protonenkonzentration (reversible Wasserstoffelektrode, RHE) eintaucht, über eine Salzbrücke miteinander in Kontakt, so hat man eine Konzentrationskette oder auch Konzentrationszelle vorliegen
Sobald man zwei Halbzellen miteinander in Kontakt bringt und den Stromkreis schließt, stellt sich das Potential der spontan stattfindenden Reaktion ein. Aufgrund der höheren Protonenkonzentration in der linken Halbzelle werden hier Wasserstoffionen zu Wasserstoff reduziert. Dabei werden der Elektrode Elektronen entzogen, und sie hat ein positiveres Potential als die Elektrode in der rechten Halbzelle. In der linken Halbzelle findet also die Reduktion statt. Diese Zelle entspricht der Kathode und ist in der galvanischen Zelle der Pluspol. In der rechten Halbzelle wird Wasserstoff oxidiert zu Wasserstoffionen. Die Elektrode hat ein negativeres Potential als die linke Elektrode (Minuspol). In der rechten Halbzelle erfolgt also die Oxidation, und sie entspricht der Anode. Die freiwillige Fließrichtung der Elektronen läuft vom Minuspol zum Pluspol, in diesem Fall – galvanische Zelle – von der Anode zur Kathode. Elektronen fließen hier also von rechts nach links, also von der verdünnten zur konzentrierten Zelle.
Das Potential wird berechnet nach E = E(rechts) – E(links). Die Standardwasserstoffelektrode muss nach IUPAC die linke Zelle sein.
Das Potential verändert sich formal mit einem positiven Vorzeichen in Abhängigkeit von der Protonenkonzentration. ABER: wir haben eine logarithmische Funktion der Protonenkonzentration. Für Konzentrationen < 1 mol/l ergeben sich also negative Potentiale, hier für eine 0,1 mol/l HCl ergeben sich -0,059 V. Rechnet man die Protonenkonzentration in den pH-Wert um, so gestaltet sich die Berechnung der Potentiale sehr viel einfacher.
E = – 0,059 pH (25°C)
Weil E < 0 Volt ist, läuft die Reaktion demnach spontan von rechts nach links ab, wie es aufgrund der unterschiedlichen Konzentrationen zu erwarten ist. Um in einer solchen Konzentrationskette nun auch negative Potentiale zu messen, müssen Sie die Standard-Wasserstoffelektrode an den Minus-Pol (Com-Port) anschließen.
Die Platinwasserstoff-pH-Elektrode pHydrunio entspricht einer solchen Messkette. Die äußere Wasserstoffelektrode misst das Wasserstoffpotential in der Messlösung. Gegen eine Normalwasserstoffelektrode, die per Definition immer das Bezugspotential 0 mV hat, ergibt sich die blaue Gerade im Diagramm, entsprechend der Berechnung nach E = – 0,059 pH (25°C).
Nun steht die innere Bezugselektrode unserer pH-Elektrode aber in Puffer pH 7. Das muss bei der Berechnung des Potentials berücksichtigt werden.
Daraus ergibt sich bei 25°C ein Offset von 0,414 V und die Messspannungen entsprechen der orangefarbenen Geraden.





 English
English