Grundlagen der elektrochemischen Potentialmessung
Wie entstehen elektrochemische Potentiale
Spannungen oder Potentiale entstehen zwischen einem Elektronenleiter (Elektrode) und einem Ionenleiter (Elektrolyt), sobald diese in Kontakt miteinander gebracht werden. Es werden solange Ladungen ausgetauscht bis sich das System in einem Gleichgewicht befindet. Einfaches Beispiel: Wird ein Eisenblech in eine Kupfersalzlösung eingetaucht, so bildet sich mit der Zeit ein Kupferniederschlag auf dem Eisen. Kehrt man das Experiment um und taucht ein Kupferblech in eine Eisensalzlösung, dann passiert nichts.
Was unterscheidet diese beiden Metalle?
Zwischen Metall und Flüssigkeit, die in Kontakt miteinander stehen, stellt sich ein Gleichgewicht ein. Aus dem Metall, das in eine Flüssigkeit seiner oder anderer Metallionen taucht, lösen sich aus seinem Gitter Metallionen heraus. Man spricht dabei vom Lösungstension (Lösungsdruck), der sich aus der Differenz zwischen Gitterenergie und Hydratationsenergie ergibt. Im Gegenzug werden Metallionen aufgrund des Abscheidungsdrucks wieder zurück in das Metallgitter gedrängt.
Im obigen Beispiel bedeutet das also, dass Eisenionen in Lösung gehen, während die in der Lösung vorhandenen Kupferionen die im Eisen verbliebenen Elektronen aufnehmen und sich als Kupfer auf dem Eisen abscheiden. Dreht man das Experiment um, geht weder Kupfer in Lösung noch werden Eisenionen abgeschieden. Der Lösungsdruck von Eisen ist also offensichtlich höher als der von Kupfer.
Dominiert der Lösungsdruck, entsteht an dem Metallstab also ein Elektronenüberschuss. Überwiegt der Abscheidungsdruck, entsteht am Metallstab ein Elektronenmangel. Es stellt sich ein dynamisches Gleichgewicht ein. Die Abscheidung der Metallionen wird dabei durch elektrische Anziehung des negativ geladenen Metalls, dem elektrischen Druck, unterstützt. Lösungsdruck, Abscheidungsdruck und elektrischer Druck führen zu einem Zustand minimaler Energie, in dem elektrische Arbeit verrichtet wird, die sich wiederum in einer Spannung am Metallstab bemerkbar macht.
Diese absolute Gleichgewichtsspannung kann als solches aber experimentell nicht bestimmt werden, da nur Spannungsdifferenzen experimentell zugänglich sind. Dazu braucht es eine zweite Elektrode, die Vergleichs- oder besser Referenzelektrode, aber auch Bezugselektrode oder Indikatorelektrode genannt. Auch deren absolute Gleichgewichtsspannung ist einzeln nicht messbar. Um die Spannungen verschiedener Metalle in ihren Lösungen miteinander vergleichen zu können, müssen diese gegen die gleiche Referenzelektrode gemessen werden. Dabei sollte eine Elektrode zum Einsatz kommen, deren Gleichgewichtsspannung sich schnell und reproduzierbar einstellt.
Hier hat sich in der Vergangenheit eine mit Wasserstoffgas umspülte platinierte Platinelektrode in Salzsäure etabliert. Die Gleichgewichtsspannung dieser Elektrode wurde bei Standardbedingungen (Hydroniumionenaktivität der Salzsäure 1 mol/l; Wasserstoffgas 1,013 bar) bei allen Temperaturen zu 0,000 V definiert. Nur dann wird die Wasserstoffelektrode als Standardwasserstoffelektrode bezeichnet. Misst man nun die Spannungsdifferenzen verschiedener Metalle in ihren Metallsalzlösungen gegen die Standardwasserstoffelektrode, ergeben sich verschiedene Spannungen, die kleiner 0,000 V oder größer 0,000 V sind.
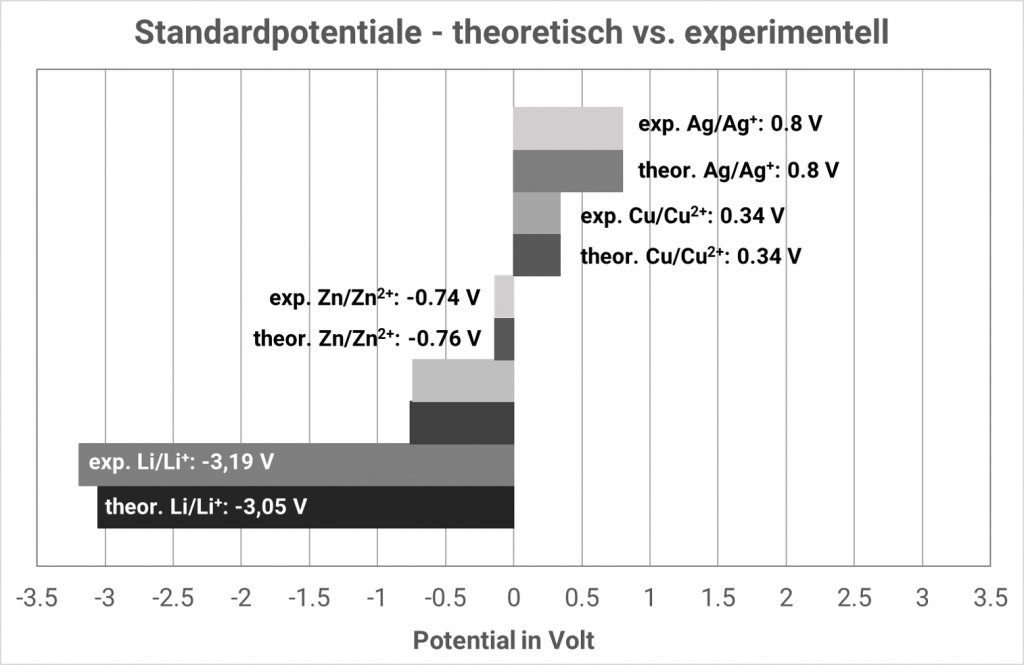
Die zu erwartenden Gleichgewichtspotentiale verschiedener Systeme bei Standardbedingungen (25°C, Metallionenaktivität 1 mol/l) sind in der sogenannten elektrochemischen Spannungsreihe zusammengetragen. Metalle mit Gleichgewichtspotentialen kleiner 0 Volt werden als unedel bezeichnet. Sind die Gleichgewichtspotentiale größer 0 Volt, dann werden die Metalle als edel bezeichnet.
Gemäß der elektrochemischen Spannungsreihe lassen sich nicht nur für Metalle, sondern auch für die Nichtmetalle und ihre Ionen sowie ionische Verbindungen und deren Umladungen Gleichgewichtspotentiale angeben. Wird ein Reaktionsteilnehmer oxidiert, entsteht dabei gleichzeitig ein Reduktionsprodukt. Und umgekehrt bildet sich ein Oxidationsprodukt, während ein Reaktionsteilnehmer reduziert wird. Es liegen also immer Redoxpaare vor. Die Gleichgewichtspotentiale sind ein Maß für das Oxidations- bzw. Reduktionsvermögen. Je negativer dieses Potential ist, umso leichter geben sie Elektronen ab. Sie werden oxidiert und wirken somit als Reduktionsmittel. Je höher das Potential ist, umso schwieriger sind sie zu oxidieren. Stattdessen sind sie einfacher zu reduzieren und wirken als Oxidationsmittel. Es lassen sich aus den Standardpotentialen die zu erwartenden Spannungen für verschiedene Kombinationen von Halbzellen berechnen. Vorhersagen über mögliche oder nichtmögliche chemische Reaktionen in wässrigen Lösungen sind möglich. Maßgeblich ist hier für die Berechnung der zu erwartenden Spannungen die Konvention E = E(rechts) – E(links).
Aktivität und Konzentration – beide Begriffe werden in der Elektrochemie verwendet. Aber was ist der Unterschied?
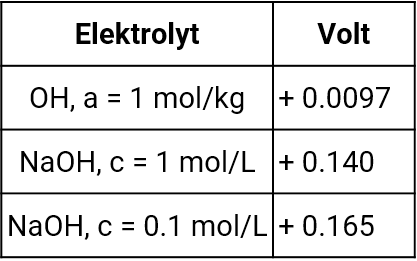
Die Stoffmengenkonzentration c gibt die Stoffmenge n einer gelösten Spezies in einem definierten Volumen an und hat somit die Einheit mol/l. Weiterhin üblich in der Chemie ist die Bezeichnung Molarität M für die Stoffmengenkonzentration in mol/l. Die Stoffmengenkonzentration ist eine temperaturabhängige Größe, weil das Volumen temperaturabhängig ist. Man kann die Stoffmenge einer gelösten Spezies auch auf das Gewicht des Lösungsmittels in kg beziehen. Dann erhält man die sogenannte Molalität b mit der Einheit mol/kg. Die Molalität ist temperaturunabhängig. Man findet die Molalitäten hauptsächlich in älteren Tabellenwerken. Des Weiteren findet man den Begriff der Aktivität einer Spezies. Die Aktivität eines Stoffes ist eine thermodynamische Größe, eine Art korrigierte Konzentration.
In einer Lösung werden die geladenen Ionen von Solvathüllen (Hydrathüllen in Wasser als Lösungsmittel) umgeben und so voneinander abgeschottet. Die Ionen sind weniger wirksam. Die Aktivität entspricht also der noch vorhandenen wirksamen Konzentration, die in der Regel aufgrund der Wechselwirkungen zwischen den Ionen in der Lösung geringer ist als die Konzentration. Nur in sehr verdünnten Lösungen sind Aktivität und Konzentration annähernd gleich. In hochkonzentrierten Lösungen dahingegen können die Aktivitäten auch höhere Werte als die Konzentration erreichen, weil nicht genügend Solvatmoleküle vorhanden sind, um alle Ionen vollständig zu solvatisieren. Die Abweichung zwischen Aktivität und Konzentration spiegelt sich in einem Korrekturfaktor, dem sogenannten Aktivitätskoeffizienten y, γ oder f, je nach dem in welcher Form die Stoffmengenkonzentration angeben wird, wieder.
Allgemeine Definition der Aktivität (entspricht nicht der physikochemischen Definition nach Jander, Jahr; Maßanalyse; 15. Auflage, 1989, de Gruyter:
a = y c c = Stoffmengenkonzentration in mol/L (Molarität)
a = γ c c = Stoffmengenkonzentration mol/kg (Molalität)
a = f c c = Gehalt des gelösten Stoffes als Molenbruch
Potential – Spannung – Elektromotorische Kraft
Alle drei Begriffe stehen für eine Spannungsdifferenz zwischen zwei Systemen. Ist der Bezugspunkt für die Messung bekannt, spricht man von Potential, andernfalls von Spannung. Elektromotorische Kraft meint die Potentialdifferenz einer Zelle, die gemessen wird, wenn die Zelle reversibel arbeitet und kein Strom fließt.
Laut Konvention der IUPAC1 wird ein Standardpotential (oder die Standardspannung) E ermittelt, in dem das Standardelektrodenpotential der rechten Zelle minus dem Standardelektrodenpotential der linken Zelle berechnet wird: E =E(rechts) – E(links)
1: Cohen et al: Quantities, units and symbols in physical chemistry, IUPAC Green Book, 3rd edn., 2nd printing, IUPAC & RSC Publishing, Cambridge, 2008, S. 71
Die IUPAC2 legt außerdem fest: „The standard potential of an electrochemical reaction, abbreviated as standard potential, is defined as the standard potential of a hypothetical cell, in which the electrode (half-cell) at the left of the cell diagramm is the standard hydrogen electrode (SHE) and the electrode at the right is the electrode in question.“
2: Cohen et al: Quantities, units and symbols in physical chemistry, IUPAC Green Book, 3rd edn, 2nd printing, IUPAC & RSC Publishing, Cambridge, 2008, S. 74
Wenn man also die Standardwasserstoffelektrode immer als „linke“ Zelle betrachtet, ergeben sich automatisch die Standardpotentiale aus der elektrochemischen Spannungsreihe, angegeben als Standard-Reduktionspotentiale. In alten Tabellenwerken findet man oft noch Standard-Oxidationspotentiale angegeben, dann sind die Vorzeichen umzukehren. Ob in einer Tabelle Oxidations- oder Reduktionspotentiale angegeben sind, erkennt man an dem Vorzeichen für die Reaktion Cu/Cu2+, denn das Standard-Reduktionspotential beträgt +0.34 V.
Dabei stellt sich immer wieder die Frage, welche Elektrode an welchen Eingang des Messgeräts angeschlossen wird, denn je nach Anschluss der Elektroden ändert sich das Vorzeichen der gemessenen Potentialdifferenz. Schließt man die Standardwasserstoffelektrode an den Minus-Eingang (COM) an, so ergeben sich die Werte wie in der elektrochemischen Spannungsreihe. Wird gegen eine andere Referenzelektrode gemessen, so wird diese an den Minus-Eingang (COM) angeschlossen. Die Messelektrode wird also stets an den positiven Pol angeschlossen: E =E(Messelektrode) – E(Referenzelektrode).
Das Vorzeichen der gemessene Potentiale spiegelt wieder, welche der Elektroden positiver ist, in welcher Richtung Strom fließt und welche der Reaktionen spontan ablaufen, da das Potential unmittelbar mit den Gleichgewichtskonstanten der Reaktionsteilnehmer verbunden ist. E > 0 für E(rechts) > E(links) bedeutet, dass die rechte Elektrode ist positiv gegenüber der linken Elektrode geladen ist.
An der rechten Elektrode herrscht also Elektronenmangel, da dort Teilchen reduziert werden. Diese Elektrode wird auch als Kathode bezeichnet. Hier erfolgt die Reduktion. Die Elektronen fließen daher von links nach rechts. Der elektrische Strom, leider definiert als Fluss positiver Teilchen, fließt somit in entgegengesetzter Richtung. An der linken Elektrode herrscht ein Elektronenüberschuss, denn dort werden Teilchen oxidiert. Diese Elektrode wird als Anode bezeichnet. Hier findet die Oxidation statt. Tendenziell läuft die Reaktion also spontan von links (Oxidation) nach rechts (Reduktion) ab. E < 0 für E(rechts) < E(links) bedeutet dann im Umkehrschluss, dass die Reaktion spontan von rechts nach links abläuft.
Potentiale messen – auch im Schulunterricht
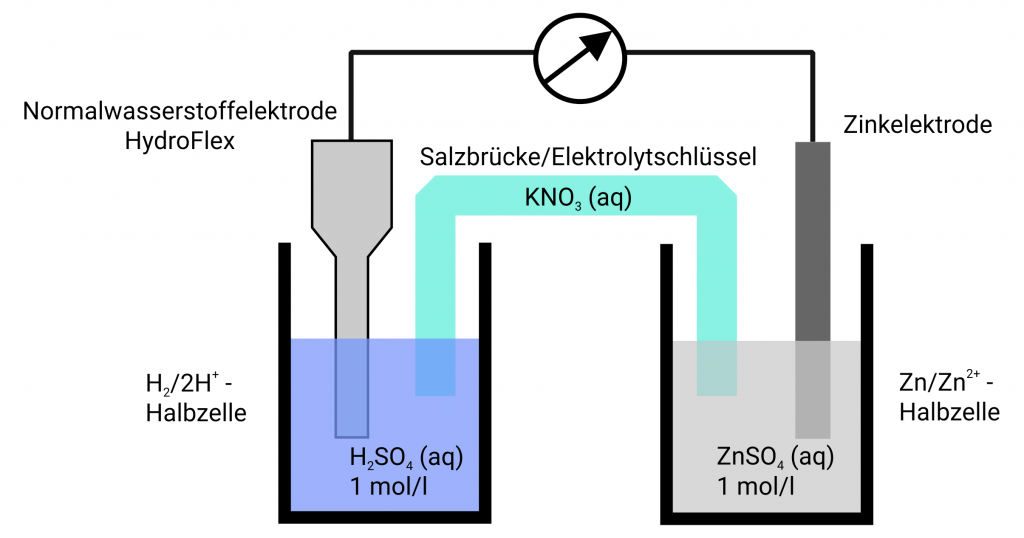
Die Messung von Potentialen erfolgt quasi stromlos. Die Elektrode mit dem zu bestimmenden Potential wird in einer entsprechenden Lösung über ein Messgerät mit einer Referenzelektrode verbunden. Je nach den Messbedingungen sind besondere Anforderungen an die Messzelle selbst gegeben. Aber auch die eingesetzten Messgeräte können Einfluss auf die Messungen nehmen. Die Eingangswiderstände der eingesetzten Messgeräte können je nach Innenwiderstand der Referenzelektrode die Potentialmessung beeinflussen oder gar verfälschen. Die Potentialmessung erfolgt bei den handelsüblichen Referenzelektroden nur dann quasi stromlos, wenn die Messgeräte sehr hochohmig sind. Andernfalls können elektrochemische Umsetzungen bei der Messung erfolgen. Die Wasserstoffreferenzelektrode HydroFlex hat einen geringen Innenwiderstand, so dass hier Handmultimeter zu Potentialmessung eingesetzt werden können – solange dass zu untersuchende System auch niederohmig ist.
Unserer Meinung nach gehört HydroFlex an jede Schule, lassen sich doch an einfachen Systemen die Standardpotentiale mit ihr normgerecht messen. Sie können HydroFlex in einem Becherglas mit in Schwefelsäure oder Salzsäure der Konzentration 1 mol/l einsetzen und haben direkt eine Normalwasserstoffelektrode vorliegen. Verbinden Sie dieses Gefäß über eine Salzbrücke, im einfachsten Fall ein mit KNO3 getränktes Filterpapier mit dem zu messenden System und Ihre Schüler können direkt am Multimeter die Standardpotentiale ablesen und mit den Tabellenwerken vergleichen.
LEYBOLD bietet unsere Wasserstoffelektrode im Versuch „Standardpotenziale von Metallen“ (C4.4.3.2B) an. D. Böhm, T. Kurzenknabe, M. Schwab, E. Geidel: Experimente zur Bestimmung von Standardpotenzialen im Chemieunterricht, Praxis der Naturwissenschaften, Chemie in der Schule, Aktuelle Entwicklungen in der Elektrochemie, Heft 8, 64. Jahrgang, Dezember 2015, Friedrich-Verlag. Gefährdungsbeurteilungen: Messung von Standardpotenzialen, Redoxpotenzial und Konzentration Weitere Informationen oder Anregungen zum Einsatz von HydroFlex im Schulunterricht finden Sie bei www.fachreferent-chemie.de. HydroFlex als praktische Wasserstoffelektrode im Unterricht wurde auf dem Bundeskongress 2014 der MNU in Kassel präsentiert. Das Skript inklusive Vortrags finden Sie hier.
Referenzelektroden mit Salzbrücke (Referenzelektroden 2. Art)
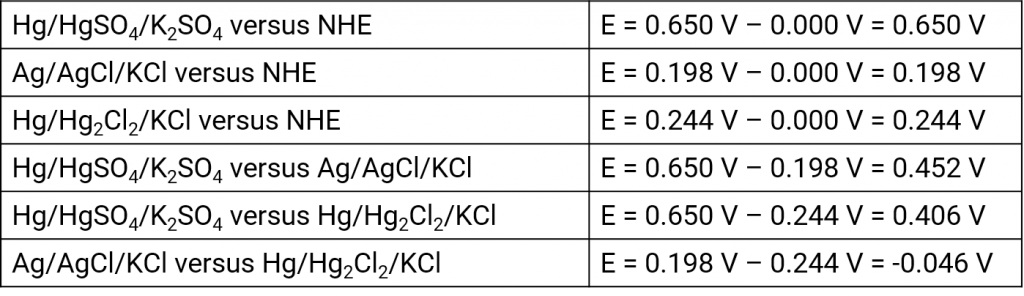
Neben der reversiblen Wasserstoffelektrode haben sich in früheren Jahren andere Systeme als Referenzelektroden etabliert, die aber alle nur mit einem Innenelektrolyten und entsprechender Elektrolytbrücke einsetzbar sind. Es handelt sich dabei um Referenzelektroden 2. Art. Diese Referenzelektroden (Bezugselektroden) sollten entsprechend der Messlösung ausgesucht werden, um Verunreinigungen sowie unnötige Diffusionsspannungen zu vermeiden. Außerdem muss das Diaphragma dann nicht so feinporig sein, was den Übergangswiderstand zwischen Messlösung und Referenzelektrode verringert. Für wässrige, saure Lösungen haben sich folgende Referenzen etabliert:
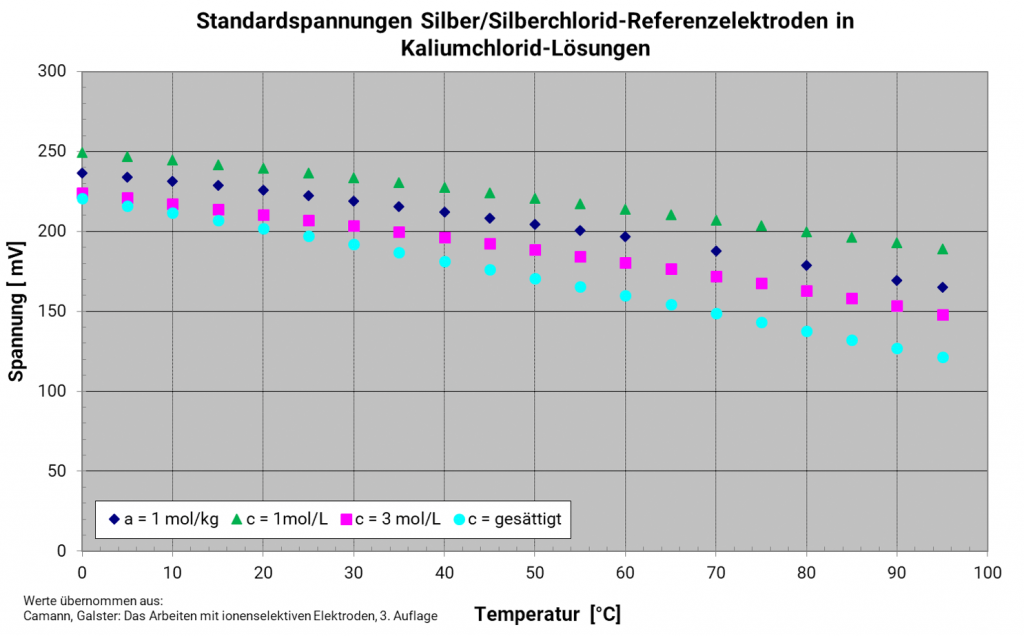
Silber-Silberchlorid-Elektrode
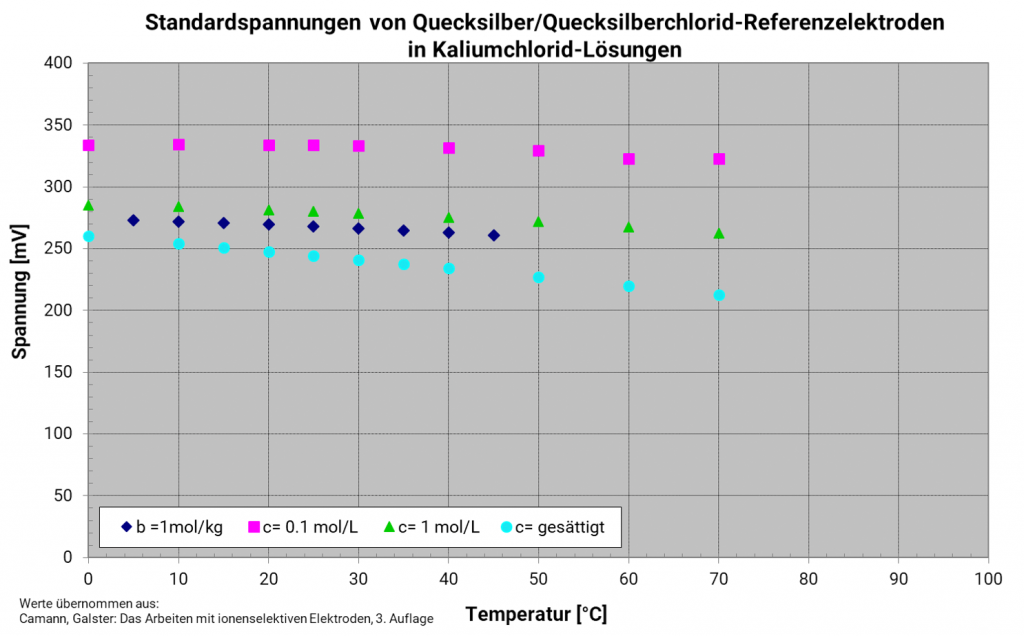
Quecksilber-Quecksilberchlorid-Elektrode (Kalomelelektrode)
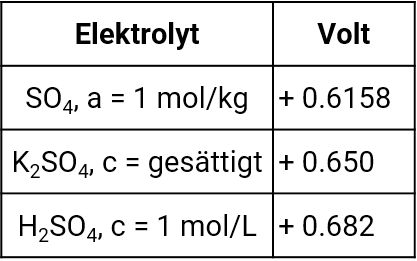
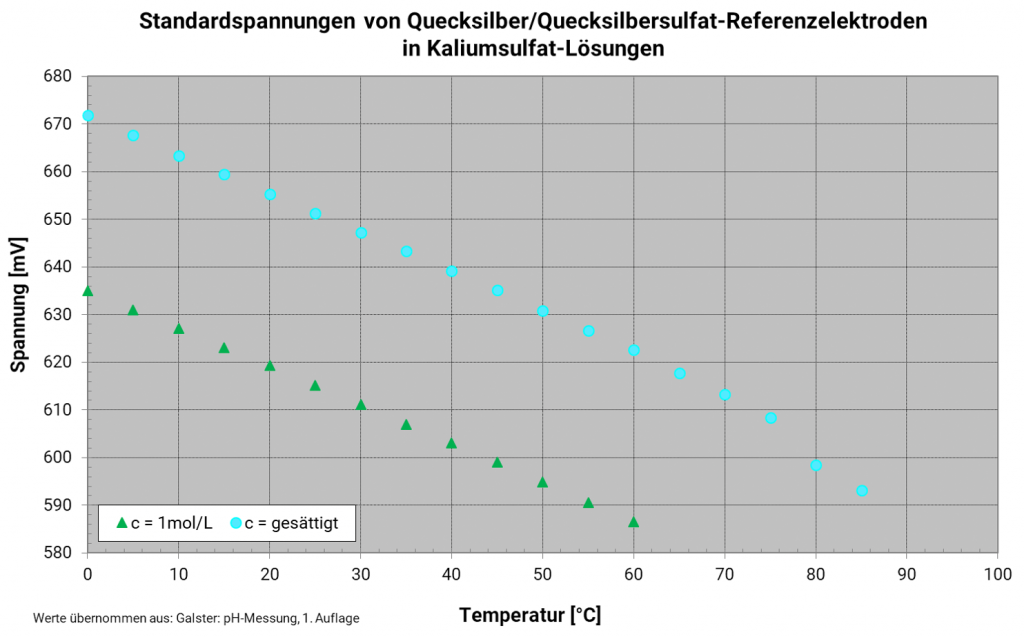
Quecksilber-Quecksilbersulfat-Elektrode
Quecksilber-Quecksilberoxid-Elektrode
Elektrolytbrücke – Salzbrücke – Elektrolytschlüssel – Stromschlüssel
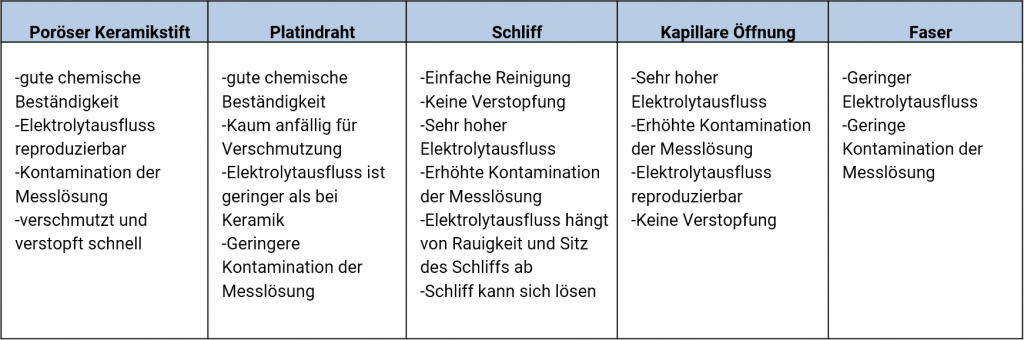
Eine Elektrolytbrücke, auch als Salzbrücke, Elektrolytschlüssel oder Stromschlüssel bezeichnet, dient zur Kontaktierung verschiedener Elektrolyte. Die ionenleitende Kontaktstelle übernimmt dabei das Diaphragma. Man findet bei den handelsüblichen Bezugselektroden in den Salzbrücken Diaphragmen aus Keramiken, Platinzwirn, Schliffen, kleinste Bohrungen, Kapillaren wie z. B. die Haber-Luggin-Kapillare, Fasern, Geweben wie Pellon oder auch aus robustem und unvermutzbarem Teflon.
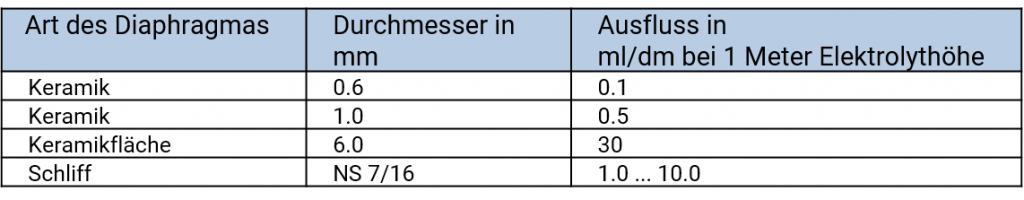
Die unterschiedlichen Materialien haben unterschiedliche Ausflussraten, die von der Porosität des Materials und von der Größe des Diaphragmas abhängen. Auch die Verarbeitung bei der Herstellung der Referenzelektroden, Beschädigungen, Verunreinigungen im Diaphragma können die Ausflussraten beeinflussen.
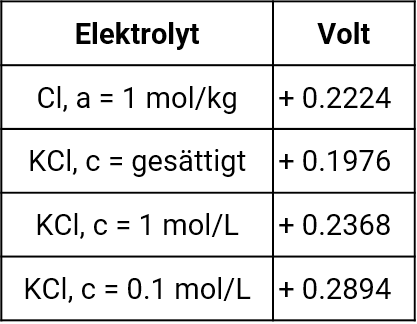
Ausflussraten der verschiedenen Diaphragmentypen, entnommen aus Galster, pH-Messung, Wiley-VCH, 1990
Bei der Verwendung von Elektrolytbrücken ist generell zu beachten, dass je nach Typ des Diaphragmas also unterschiedliche Mengen an Innenelektrolyt in die Messlösung ausfließen werden. Die Auswahl der Referenzelektrode richtet sich daher auch nach der Messlösung, in der sie eingesetzt werden soll. Um Verunreinigungen des Innenelektrolyten in den Referenzelektroden durch eindiffundierende Messlösung zu vermeiden, ist ein Ausströmen des Innenelektrolyten in die Messlösung notwendig. Dazu sollte die Einfüllöffnung während der Messungen offen oder zumindest nicht luftdicht verschlossen sein. Der Füllstand des Innenelektrolyten sollte deutlich über dem Pegel der Messlösung liegen.
In schwierigen Messmedien wie z. B. stark verschmutzt oder hochviskose Proben werden bevorzugt Schliffdiaphragmen wegen ihrer hohen Ausflussraten eingesetzt.
Bezugselektroden mit festem Innenelektrolyten haben keinen Elektrolytausfluss. Allerdings kann hier durch das Diaphragma Messlösung in den verfestigten Innenelektrolyten eintreten und diesen verunreinigen, gegebenenfalls auflösen und verdünnen. Innenelektrolyt aus den Referenzelektroden verunreinigt Ihre Messlösung. Referenzelektroden müssen immer wieder nachgefüllt werden.
Der Flüssigkeitsstand in der Referenzelektrode muss stets über dem Pegel der Messlösung liegen. Referenzelektroden mit Festelektrolyt werden mit der Zeit schlechter, da sich der Festelektrolyt aufgrund aus der Messlösung eindringender Ionen verändert. An jedem Diaphragma entsteht eine Diffusionsspannung, die zu Abweichungen des gemessenen Potentials führt.
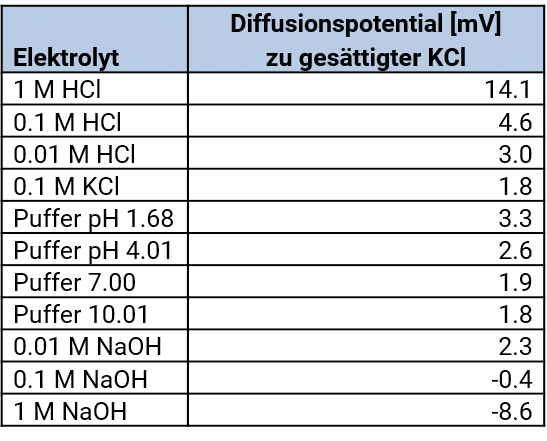
Diffusionsspannung – Diffusionspotentialel
Das Diaphragma ist die Kontaktstelle zwischen Brückenelektrolyt und Messelektrolyt. An dieser Stelle treten sogenannte Diffusionsspannungen auf, weil die Anionen und Kationen verschiedener Elektrolyte unterschiedliche Wanderungsgeschwindigkeiten haben. Diffusionsspannungen können durch die Wahl des Brückenelektrolyten und Art der Salzbrücke minimiert werden.








 English
English